カリキュラム
| 第1日 5月13日(金) | 主催者からひとこと 薬事業務習得のための 6つのstep |
||
|---|---|---|---|
| 時限 | 講習タイトル | 講習内容 | |
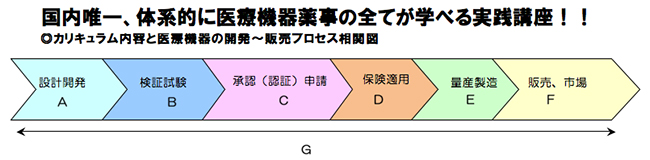
| 1 | G 医療機器と薬事規制 | 「医療機器とは何か。」 という基礎から始め、医療機器にかかる開発から販売後までの一連の薬事規制、開発プロセスの重要性を解説します。 |
STEP1薬事担当者として、また新規参入企業としての第一歩です。 医療機器の薬事規制に関する基本的な内容、医療機器企業として日々取り組まなければならない事項を体系的に習得します。 薬事の全体的、基本的内容を学習せずして、薬事対応は出来ません。 |
| 2 | G 薬事コンプライアンス(広告含む)と薬事関連情報の収集 | 医療機器企業としてのコンプライアンスを学び、薬事業務を進めるために必要な情報と、収集する手段を伝授します。これにより必要な情報を迅速且つ的確に収集することが可能となります。 | |
| 3 | E F 製造業登録 製造販売業許可 |
製造販売業許可、製造業登録とは何か、どのようなケースで必要となるのか、事例を含めて説明します。また、許可、登録の取得(更新)要件と準備、実際の調査時の留意点についても説明します。 | |
| 4 | F GVP省令 | 製造販売業者の許可要件である安全管理(GVP)に関する要求事項について分かりやすく解説し、実際に事例を紹介して指摘されやすい点を中心にそのクリアポイントを伝授します。 | |
| 第2日 5月27日(金) | |||
| 時限 | 講習タイトル | 講習内容 | |
| 1 | A E F QMS省令① | 薬機法において、製造業者だけでなく製販業者にも要求されている品質マネジメントシステムであるQMSの要求事項の解説と、具体的対応、また、実際の調査時の留意点について、QMS調査に携わる講師より分かりやすく解説いたします。 | |
| 2 | A E F QMS省令② | ||
| 3 | A E F QMS省令③ | ||
| 4 | A E F QMSとISO | ISO9001、ISO13485とQMSとの差分を理解し、ISO認証取得企業の薬機QMS対応、QMS構築企業のISO認証取得対応のポイントを解説します。 | |
| 第3日 6月10日(金) | 主催者からひとこと 薬事業務習得のための 6つのstep |
||
|---|---|---|---|
| 時限 | 講習タイトル | 講習内容 | |
| 1 | C 製品の手続き | 製品に必要な手続きはどのようなものか?医療機器の分類別に各手続きと留意事項を説明します。 |
STEP2製品の設計開発、製品の薬事手続きの基本的内容と審査制度を習得するとともに、これまでの内容の再確認を行います。 STEP3の実務カリキュラムにスムーズに入っていただくための重要なステップとなっています。 |
| 2 | C E F 動物用医療機器 | 動物用医療機器の業許可、製品の手続きを解説し、さらに人用医療機器を動物用医療機器へ転用する場合の注意点を伝授します。 | |
| 3 | C 外国申請 | 外国へ輸出する際に必要な手続き(米国FDA、EU諸国CE)における各手続きの流れ、審査の現状を説明します。 | |
| 4 | A C 医療機器のリスクマネジメント | 製品手続きに必要となるリスクマネジメントについてJIS T 14971を参考に、ハザードの特定、リスク評価等の基本的考え方、手法を解説し、実際にリスクマネジメントを実施していただきます。 | |
| 第4日 6月24日(金) | |||
| 時限 | 講習タイトル | 講習内容 | |
| 1 | 前期考査(確認テスト) | 前期カリキュラムの内容から特に間違えやすい事項、間違ってはいけない事項を中心に50問のテスト形式(記述、択一)で実施いたします。 | |
| 2 | グループ ディスカッション① |
医療機器新規参入企業の薬事ロードマップをテーマ(課題)とし、グループ内で討論及び講師へ提案していただきます。 これにより、薬事課題の解決スキルを養成します。 |
|
| 3 | |||
| 4 | C 第三者認証制度 | 管理医療機器(クラスⅡ)に加え、高度管理医療機器(クラスⅢ)の第三者認証制度について第三者認証機関の審査員より解説いたします。 | |
| 第5日 7月8日(金) | 主催者からひとこと 薬事業務習得のための 6つのstep |
||
|---|---|---|---|
| 時限 | 講習タイトル | 講習内容 | |
| 1 | C 認証申請実務 ① | 認証機関の選定方法、自社で行う事前評価(認証基準適合性)、認証申請書及び添付資料(STED)の作成ポイントを分かりやすく説明します。 |
STEP3薬事手続きの中で最も難易度が高いと言われる医療機器承認(認証)申請の具体的内容と作成実務を習得します。 このステップを終了した時点で、基本的な実務がこなせる薬事担当者となっているはずです。 |
| 2 | C 認証申請実務 ② | ||
| 3 | C プログラムの認証申請 | 薬機法で新たに医療機器となった医療用プログラム特有の認証申請におけるポイントを分かりやすく説明します。 | |
| 4 | C 承認制度と信頼性調査 | 申請区分と審査制度の解説に加え、特に昨今の承認審査で厳しく審査されている添付資料(各種試験成績書)の信頼性調査への対策を説明します。 | |
| 第6日 8月29日(月) | |||
| 時限 | 講習タイトル | 講習内容 | |
| 1 | C 承認申請実務 ① | 製品の特性を踏まえた申請方針(申請区分と新規/一部変更)の立て方、必要試験の見極め方を中心に“申請準備”を学びます。 | |
| 2 | C 承認申請実務②(後発) | 承認事項となる承認申請書の記載項目と記載方法、更に医療機器の特性による各項目記載の留意点を説明します。 さらに、既存品との同等性、差分評価、リスクマネジメント、検証試験結果をどのように添付資料(STED)に反映させるべきかを中心に解説します。 |
|
| 3 | |||
| 4 | |||
| 第7日 9月2日(金) | 主催者からひとこと 薬事業務習得のための 6つのstep |
||
|---|---|---|---|
| 時限 | 講習タイトル | 講習内容 | |
| 1 | B 臨床試験 | 初めての治験を想定し、GCP基準の解説、治験デザイン(症例数、プロトコル)の基本的考え方、治験依頼者としての留意事項を分かりやすく解説いたします。 |
STEP4STEP3の承認(認証)申請スキルをさらに向上させる内容となっています。 まさに“プロ”の薬事担当者を育成するステップとなっています。 |
| 2 | B 生物学的安全性 (植込み/接触材料) |
GLP基準の適用となっている生物学的安全性試験の国内ガイドラインの内容、また外国規格との相違点を中心に試験機関担当者より分かりやすく解説いたします。 | |
| 3 | B 電気的安全性、電磁両立性(医用電気機器) | JIS規格を中心に医用電気機器に求められる電気的安全性、電磁両立性の各項目を解説します。 | |
| 4 | B 申請に必要な試験データ ~試験データレビュー~ |
申請書に添付する生物学的安全性試験、電気的安全性試験の試験成績書を題材に薬事担当者として行うべき最低限の事前評価項目とその評価方法を伝授します。 | |
| 第8日 9月21(水) | 主催者からひとこと 薬事業務習得のための 6つのstep |
||
|---|---|---|---|
| 時限 | 講習タイトル | 講習内容 | |
| 1 | C 審査照会対応ケーススタディ(歯科材料) | 最近の審査照会を多数取り上げ、対応事例を解説し、迅速、確実な認証/承認取得のスキルアップを図ります。 |
STEP5申請資料が作成できても承認(認証)が得られなければ意味がありません。 ここでは様々な審査実例の具体的内容を習得し、“成果に結びつけるスキル”を習得するステップとなっています。 |
| 2 | C 審査照会対応ケーススタディ(植込み/接触材料) | ||
| 3 | C 審査照会対応ケーススタディ(医用電気機器) | ||
| 4 | D 保険適用 | 保険適用の手続きから保険収載までの流れ、手続き書類作成の留意点を説明します。 | |
| 第9日 9月26日(月) | 主催者からひとこと 薬事業務習得のための 6つのstep |
||
|---|---|---|---|
| 時限 | 講習タイトル | 講習内容 | |
| 1 | 後期考査(確認テスト) | 全カリキュラム内容から特に間違えやすい事項、間違ってはいけない事項を中心に50問のテスト形式(記述、択一)で実施します。 |
STEP6カリキュラム最後は重要事項の総まとめを行います。 「薬事の学校」修了後は、“薬事初任者”ではなく、他のスタッフの指導も行える“薬事責任者”の誕生です。 |
| 2 | まとめ | 前期及び後期考査の問題解説を行い、重要ポイントを正しく習得します。 | |
| 3 | グループ ディスカッション② |
実際の申請書類をテーマ(課題)に、その不備についてグループ内で討論し、是正内容を講師へ提案していただきます。 これにより、薬事課題の解決スキルを養成します。 |
|
| 4 | |||
備考
- ご参加者同士の意見交換の場として懇親会を前期、後期の2回開催する予定です。
- 開催日程は基本的に毎月第2週、第4週の平日です。
(会場の都合により変更あり。平成28年3月下旬 に詳細日程をお知らせいたします。)